- Người mới xăm môi có ăn được thịt vịt không?
- Ứng dụng tế bào gốc: Trị sẹo và triển vọng trong ngành y học
- Phương pháp Laser nội mạch: Hiểu rõ và tận dụng ưu điểm
- Kem nghệ và vitamin Thái Dương Nano Bạc: Nuôi dưỡng da, mờ vết thâm, nám
- An cung Hàn Quốc – Vũ Hoàng Thanh Tâm: Sự kết hợp hoàn hảo của yếu tố truyền thống và hiện đại
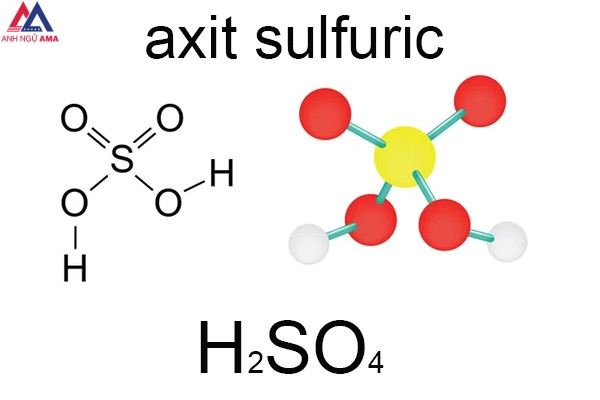
Axit Sunfuric, hay còn được gọi là H2SO4, là một hợp chất hóa học phổ biến và được sử dụng rộng rãi trong đời sống hàng ngày. Hãy cùng tìm hiểu về H2SO4, từ tính chất đến các ứng dụng của nó.
Bạn đang xem: H2SO4: Tác dụng, ứng dụng và tính chất
Contents
H2SO4 là gì?
H2SO4, còn được biết đến với tên Acid Sunfuric, là loại axit vô cơ quan trọng nhất hiện nay. Nó được tạo thành từ sự kết hợp giữa lưu huỳnh (S), oxy (O) và hydro (H), với công thức hóa học H2SO4. Đây cũng được coi là “ông vua” trong ngành hóa học và đóng vai trò quan trọng trong công nghiệp.
Tính chất vật lý của H2SO4
H2SO4 có dạng chất lỏng không màu, không mùi và không vị. Tính chất này không thay đổi, cho dù nó ở dạng đặc hay loãng. Axit Sunfuric khá nặng hơn nước và tan trong nước vô hạn.
Axit Sunfuric có khả năng cư tỏa nhiệt mạnh khi tiếp xúc với nước. Khi làm thí nghiệm, ta nên cho từ từ H2SO4 đặc vào nước để tránh bắn lên và gây bỏng. Loại axit này cũng có khả năng than hóa các hợp chất hữu cơ.
Tính chất hóa học của H2SO4
H2SO4 là một axit cực mạnh. Tính axit mạnh và tính bào mòn của nó làm cho nó có thể gây nguy hiểm cho mọi vật chạm vào nó với đủ nồng độ. Axit Sunfuric có tính oxi hóa và tính háo nước, và có khả năng tạo ra các loại acid khác có khả năng bay hơi.
Axit Sunfuric còn có thể làm thay đổi màu của giấy quỳ tím sang màu đỏ. Ngoài ra, nó tồn tại dưới hai dạng: axit đặc và axit loãng.

Hình minh họa: Tính chất hóa học của H2SO4
Tính chất hóa học của H2SO4 đặc
H2SO4 đặc có tính axit mạnh do lưu huỳnh có mức oxi hóa +6 cao nhất. Điều này làm cho nó tác dụng được với hầu hết các kim loại, trừ vàng và bạch kim (Pt). Khi tiếp xúc với kim loại và nhiệt, Axit Sunfuric tạo thành muối kim loại có hóa trị cao, chất lỏng và khí SO2 (H2S, S).
2Al + H2SO4 đặc nóng → Al2(SO4)3 + 3SO2 + 6H2O
Cu + H2SO4 đặc nóng → CuSO4 + SO2 + 2H2O
2Fe + H2SO4 đặc nóng → Fe2(SO4)3 + 3SO2 + 6H2O
3Cr + 4H2SO4 đặc nóng → 3CrSO4 + 4H2O + S
Xem thêm : Sau khi đi đám tang về, bạn nên làm gì?
H2SO4 đặc nguội sẽ bị thụ động hoá với nhôm (Al), sắt (Fe) và crom (Cr), nên không thể tạo ra phản ứng. Ngoài ra, Axit Sunfuric đặc còn tác dụng với các chất phi kim, tạo thành oxit phi kim, nước và khí SO2.
S + 2H2SO4 đặc nóng → 3SO2 + 2H2O
H2SO4 đặc nóng tác dụng với các chất khử khác để tạo thành muối, nước và khí SO2.
H2SO4 đặc nóng + 8HI → H2S + 4I2 + 4H2O
Tính chất hóa học của H2SO4 loãng
Axit Sunfuric ở dạng loãng vẫn là một axit mạnh, có tính chất tương tự một axit thông thường. Nó có thể thay đổi màu của giấy quỳ tím sang màu đỏ và tác dụng với kim loại, bazơ, oxit bazơ và muối để tạo ra các chất cần thiết.
Axit Sunfuric có thể tác dụng với các kim loại trừ hidro, tạo thành muối sunfat:
Fe + H2SO4 → FeSO4 + H2
Axit Sunfuric cũng tác dụng với oxit bazơ, tạo thành muối mới và nước:
FeO + H2SO4 → FeSO4 + H2O
Ngoài ra, Axit Sunfuric kết hợp với bazơ để tạo thành muối mới và nước:
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
Axit Sunfuric còn tác dụng với muối để tạo ra axit mới và muối mới:
Xem thêm : Bầu 3 tháng đầu ăn đậu xanh có tốt không?
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2↑
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2↑
HCO3 là một axit yếu, vì vậy nhanh chóng chuyển thành H2O và CO2 sau khi được tạo ra.
Các dạng của axit Sunfuric (H2SO4)
H2SO4 có nhiều dạng khác nhau tùy thuộc vào mục đích sử dụng:
- H2SO4 loãng được sử dụng trong phòng thí nghiệm với nồng độ chỉ 10%.
- Axit Sunfuric với nồng độ 33.5% được sử dụng trong bình ắc quy.
- Hàm lượng 62.18% thường được sử dụng để sản xuất phân bón.
- H2SO4 với nồng độ 77.67% được sử dụng trong quá trình sản xuất axit glover.
- H2SO4 đậm đặc có nồng độ 98%.
Cách điều chế H2SO4
Có nhiều phương pháp điều chế H2SO4, trong đó điểm chung là sử dụng quặng Pirit sắt hoặc oleum.
Đốt cháy quặng Pirit sắt
FeS2 + O2 → SO2 + Fe2O3
Oxi hóa SO2 thông qua oxi và chất xúc tác V2O5
SO2 + O2 → SO3
Axit Sunfuric đặc hấp thụ SO3 để tạo ra oleum
nSO3 + H2SO4 → H2SO4.nSO3
Pha loãng oleum với nước
H2SO4.nSO3 + (n+1) H2O → (n+1)H2SO4
Ứng dụng của H2SO4
H2SO4 được sử dụng rộng rãi trong nhiều ngành công nghiệp với vai trò là nguyên liệu chính hoặc chất xúc tác cho các phản ứng hóa học. Nó được sử dụng trong sản xuất phân bón, chất tẩy rửa tổng hợp, công nghiệp sợi hóa học, chất dẻo và sơn màu.
Axit Sunfuric còn được sử dụng để điều chế axit nitric, axit clohidric và nhiều chất hóa học khác trong phòng thí nghiệm. Trong công nghiệp, nó rất phổ biến trong sản xuất luyện kim, phẩm nhuộm, chất dùng để tẩy rửa, sản xuất giấy và sợi.
Kết luận
H2SO4, hay Axit Sunfuric, là một hợp chất hóa học quan trọng và có nhiều ứng dụng rộng rãi. Qua bài viết này, chúng ta đã tìm hiểu về H2SO4, từ tính chất đến ứng dụng của nó. Hi vọng những kiến thức về hợp chất hóa học này sẽ hữu ích cho bạn.
Nguồn: https://readyq.vn
Danh mục: Sức khỏe